2016年CDER新药审评情况简介
时间:2017-08-03 来源:iReg
2016年CDER一共批准了22个新药,其中大部分新药都可能会对严重或有生命危险的疾病产生非常显著的临床价值。在2016年批准的新药里首次有治疗脊髓肌肉萎缩症、首次治疗杜兴氏肌营养不良的药物,治疗帕金森患者的幻觉妄想的新药,治疗罕见的慢性肝病——肝夏科氏肝硬变的药物,两种治疗丙型肝炎的新疗法。同时还有治疗卵巢癌、膀胱癌、软组织肉瘤和慢性淋巴细胞白血病的肿瘤药品。
其中73%的批准新药是得益于FDA加速药物研发和审批的项目(例如:快速申请通道、突破性药物、优先审评和加速审评等)。同时CDER审评团队在2016年的新药审评中有95%达到了PDUFA规定的goal date,并且有95%的新药是在‘first cycle’中被批准的,也就是说没有需要额外的信息而延迟审批或开始类外一个审批cycle,同时86%的新药申请首先在美国被批准,这说明CDER 会在申请递交给FDA后尽可能快的审核药品。
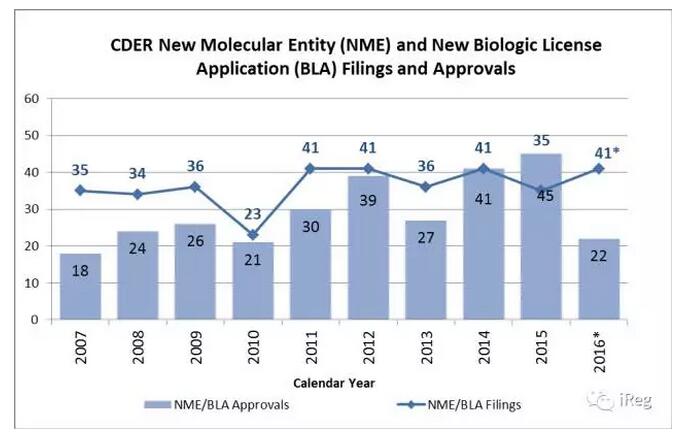
2016年FDA批准的新药数量低于去年批准的45个,同时也低于过去十年的平均值29个,但是向CDER递交的申请与往年数量保持了相对的稳定,从上图中可以看出,CDER在2016年评估了41个注册文件,与往年持平。究其原因主要包括以下几点:首先2015年递交的新药申请与最近10年平均每年35个的申请数量相似,考虑到注册文件递交申请时间的自然波动和他们的PDUFA goal date,意味着一小部分的新药申请会在近几年产生作用。下面简单介绍一下PDUFA date,根据PDUFA,FDA将要发给申请者一份信函给申请者,或者批准,或者不批准。对于新的NDA,目标是或者在6个月内或者10个月内,发出信函。这个时间就是,PDUFA date,即FDA发函明示批准与否的日期。例如,CDER在2015年批准了5个新药但是这些新药的PDUFA goal date是在2016年,这些提前批准的药品将使得患者尽早从该药物中获益,但是仍然会拉低2016年批准新药的总数量。
另外一个影响因素是完整回复(complete response,CR)的数量,该数量反映了申请的缺陷、初步审评、给申请者需要向FDA重新递交申请时需要做什么的建议。CDER在2016年共发布了14个CR letter,比最近几年都高。在2016年CR letter中提到的审查缺陷显示导致申请没有通过的最主要的缺陷是没有符合FDA cGMP(currentGood Manufacturing Practice)的要求。CR letter的数量显示没有达到cGMP要求的申请在2016年里异常的高,通过对比可以发现,在2010-2015年间47个新药申请中只有4个被提个CR letter。2016年的数据可能会给申请者一个提醒,即所有的生产设备都必须达到cGMP法规的要求如果他们希望确保申请被通过。
